Ce site utilise des cookies afin que nous puissions vous fournir la meilleure expérience utilisateur possible. Les informations sur les cookies sont stockées dans votre navigateur et remplissent des fonctions telles que vous reconnaître lorsque vous revenez sur notre site Web et aider notre équipe à comprendre les sections du site que vous trouvez les plus intéressantes et utiles.
Mieux comprendre le champ d’application du règlement APA de l’Union Européenne
Paris, le 23 mars 2021 – Le règlement nº 511/2014 de l’Union Européenne (ci-après nommé « Règlement APA de l’UE ») s’applique depuis le 12 octobre 2014, date à laquelle le protocole de Nagoya est entré en vigueur pour l’Union. Il est complété par le règlement d’exécution n°2015/1866, entré en vigueur le 9 novembre 2015.
Tant le règlement APA que son règlement d’exécution sont directement applicables dans tous les États membres de l’Union Européenne.
Consciente des nombreuses questions soulevées par la mise en place de ces nouvelles dispositions juridiques, la Commission européenne a publié le 12 janvier 2021 une seconde version du “Document d’orientation sur le champ d’application et les obligations essentielles du règlement (UE) nº 511/2014 relatif aux mesures concernant le respect par les utilisateurs dans l’Union du protocole de Nagoya sur l’accès aux ressources génétiques et le partage juste et équitable des avantages découlant de leur utilisation” (2021/C 13/01).
Vous pourrez la consulter sur ce lien.
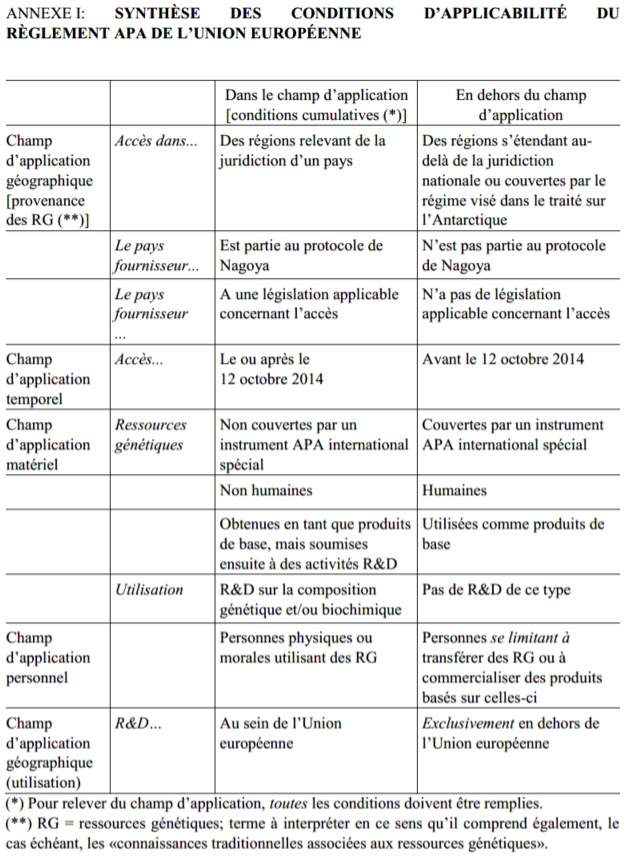
Ce Document d’orientation clarifie les champs d’application temporel, géographique et matériel du règlement APA de l’UE (point 2), ainsi que les obligations essentielles imposées par ce règlement, telles que l’obligation de diligence nécessaire et de soumission des déclarations associées (points 3 et 4, respectivement).
S’il reprend l’ensemble des informations qui avaient déjà été fournies dans le premier Document d’orientation 2016/C313/01 publié en 2016, il est désormais enrichi de nombreux exemples, concrets et précis, relevant de domaines techniques variés, qui apportent un nouvel éclairage fort instructif. En outre, un grand nombre de sujets d’importance, fruits des discussions avec les utilisateurs, y sont développés.
Voici un petit vade-mecum qui vous permettra de mesurer l’ampleur et la densité des informations que ce Document recèle.
a) Le Document explique pourquoi le Règlement APA de l’UE s’applique bien aux ressources suivantes :
- Espèces exotiques (envahissantes ou non, introduites intentionnellement ou non dans le pays où elles ont été prélevées) (point 2.1.4)
- Organismes de biocontrôle implantés dans le pays où ils ont été libérés (point 2.1.5)
- Pathogènes et organismes nuisibles introduits de manière non intentionnelle en UE, sauf s’ils sont prélevés sur un voyageur, un animal, un végétal, un micro-organisme, une denrée alimentaire, ou tout autre matériel introduit de manière non intentionnelle dans un pays de l’Union Européenne (point 2.3.1.5).
b) Le Document explique pourquoi la situation est plus complexe en ce qui concerne les ressources suivantes :
- Organismes associés à une ressource génétique importée dans l’UE (point 2.3.1.6.)
- Microbiote humain (point 2.3.1.7)
- Dérivés biochimiques non génétiques (point 2.3.4)
- Données de séquençage (point 2.3.5).
Pour ce type de ressources, l’analyse doit en fait être réalisée au cas par cas, éventuellement au regard des lois nationales du pays fournisseur de la ressource.
c) Le Document indique enfin comment réagir dans des situations variées :
- Acquisition indirecte de ressources génétiques (point 2.1.3)
- Acquisition et utilisation à des dates postérieures / antérieures au 12 octobre 2014 (point 2.2.)
- Impossibilité de déterminer le pays fournisseur (point 3.3.).
d) Deux Annexes fort intéressantes sont jointes à ce Document :
(i) L’Annexe I présente synthétiquement les conditions d’applicabilité du Règlement APA de l’UE (voir ci-dessous).
(ii) L’Annexe II du Document apporte quant à elle de nombreuses précisions permettant d’établir si notre « utilisation » de la ressource relève du champ d’application du Règlement APA de l’UE. Elle est structurée de manière à suivre, aussi étroitement que possible, la logique de la chaîne de valeur, de l’acquisition à la mise sur le marché d’un produit. Elle évoque le stockage, l’identification, la caractérisation, le développement et les phases de tests du produit.
Notamment, dans cette Annexe, un chapitre particulier est dédié à la problématique du stockage et de la gestion des collections (chapitre 3). Un autre chapitre présente les problématiques liées à la sélection animale et végétale (chapitre 8). Les notions de criblage à grande échelle y sont également discutées (point 6.5). Le chapitre 7 décrit quant à lui les obligations auxquelles sont soumises les personnes qui utilisent les ressources génétiques en tant qu’outils de test ou de contrôle (pathogènes hôtes, souches de laboratoires, etc.).
Que vous travailliez pour le compte d’une société privée, d’un organisme public (université, organisme de vérifications réglementaires) ou que vous soyez un fournisseur de ressource (agriculteur, éleveur, collection, vendeur, etc.), ces documents vous seront très utiles si vous effectuez de la R&D en Europe à partir de ressources génétiques ou de dérivés biochimiques !
Ils vous permettront en effet de savoir si votre projet doit – ou non – faire l’objet des démarches déclaratoires prescrites par le Règlement (voir notre précédent article).
Attention ! N’oubliez pas que plusieurs États membres de l’UE imposent des mesures supplémentaires en rapport avec l’APA. Vous devez donc en outre vous renseigner au sujet de ces mesures nationales, même s’il apparaît que votre activité n’est pas couverte par le règlement APA de l’Union Européenne.
Le Groupe de Travail Biodiversité de REGIMBEAU se tient à votre disposition pour évaluer, au cas par cas, les démarches à effectuer au regard de ces législations complexes. Des problématiques précises, liées aux points évoqués ci-dessus, seront développées dans nos prochains articles. A suivre !